界面新闻记者 |
界面新闻编辑 | 谢欣
中国创新药近些年的突破有目共睹,但在出海授权(BD)逐渐“失灵”之际,真正的竞争可能才刚刚开始。
11月23日晚,百利天恒公告称,EGFR×HER3双抗抗体偶联药物(ADC)iza-bren的药品上市申请(NDA)已获受理,适应症为鼻咽癌。iza-bren是全球目前唯一进入III期临床阶段的EGFR×HER3双抗ADC,也是全球首个药品上市申请获得受理的EGFR×HER3双抗ADC。
iza-bren是诸多同类首创(FIC)级别中国创新药中的一个,这类产品不断向上市阶段迈进,意味着中国创新药的水平在不断提升。据《人民日报》9月报道,仅上半年内,国内批准创新药43个,同比增长59%;另在过去5年内,中国共批准创新药210个,保持加速增长态势;目前,中国在研创新药约占全球30%。
“中国曾在PD-1/PD-L1领域落后,但告诉大家,我们在双抗领域绝对不落后”,11月22日,同济大学医学院肿瘤研究所所长周彩存在首届上海临床试验论坛(SFCT)上做出前述发言。在2024年5月,依沃西单抗注射液获批,成为全球首个获批的PD-1/VEGF双特异性抗体,标志着中国创新药在此领域建立领先优势。
在上海临床试验论坛上,周彩存还表示,曾有国际同行和他提出:“不看好ADC,认为ADC就是化疗”,但基于芦康沙妥珠单抗(SKB264/MK-2870)等的临床数据,他认为这位国际同行错了。

他提出:“ADC不单是化疗,ADC一个分子由三个(部分组成),包括抗体、毒素和linker(连接子)”,这背后提示了中国拥有巨大的工程师红利;ADC药物在治疗EGFR突变的肺癌患者中具有优于化疗的潜力,“这个方向是中国专家找出来的”。今年3月,芦康沙妥珠单抗成为全球首个在肺癌适应症获批的TROP2 ADC药物。此前,它的首个适应症是三阴性乳腺癌。
近两年,中国的双抗和ADC类药物都十分出彩,这还加速了中国药企的出海进程。在2024年,仅是交易总额在10亿美金以上的对外授权交易,就有将近20起。
这其中包括礼新医药的PD-1/VEGF双抗(LM-299)、普米斯的PD-L1/VEGF双抗(PM8002)、同润生物的CD3/CD19双抗(CN201)、宜明昂科的PD-L1/VEGF双抗(IMM2510)、宜联生物的cMET ADC(YL211)、麦科思生物的(PTK7 ADC)MTX-13 等等。
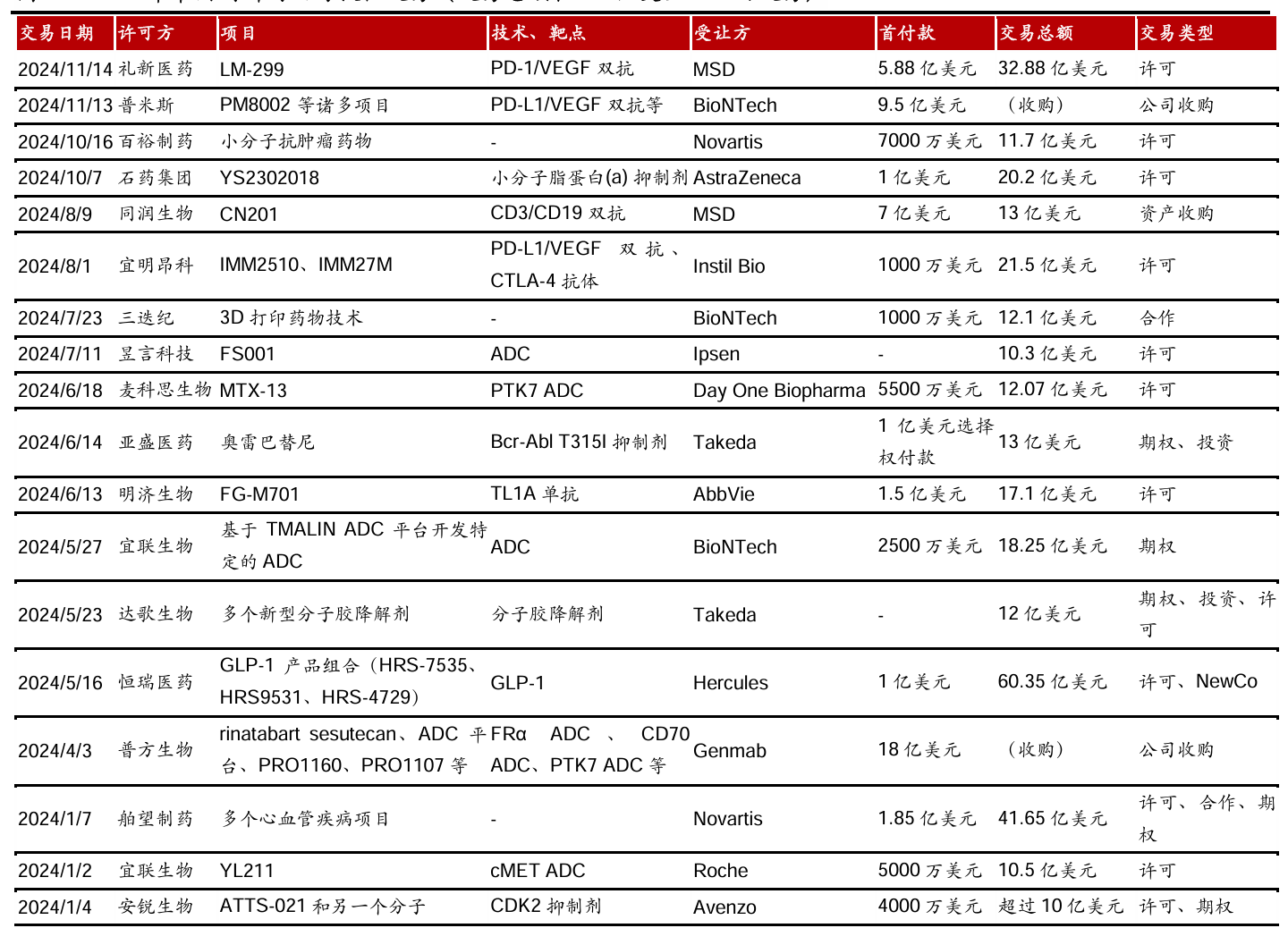
自年末起的PD-1/VEGF双抗类交易案例,更是将“出海授权(BD)”推成了中国创新药的叙事主线。不过,据医药魔方的统计,中国的对外授权(license-out)交易总金额自2022年来就逐年上升并超过融资金额;对外授权早已成为国内企业增厚资金的重要途径。
二级市场上,据《21世纪经济报道》援引万得(Wind)数据,2025年上半年,覆盖A股市场的万得医药大类指数年内上涨26.74%,而港股恒生医疗保健指数前六个月涨幅达47.89%。
不过,自今年年中起,创新药板块持续回调。同时,国产创新药的BD似乎不再能激励股市。比如,10月中旬,信达生物宣布与武田达成了12亿美元首付款、交易总额高达114亿美元的合作,但在宣布合作当日,公司股价收跌1.96%。同一阶段,市场也时不时发出中国创新药在BD之后还能期待什么的质疑。
11月22日,上海全球健康创新研究院院长何如意在上海临床试验论坛上肯定了药企出海的意义。他表示,对于中国药企而言,避开国内的同质化竞争,将产品海外授权,利用大药企的商业化能力弥补自身缺点,目前来看是较为正确的道路。
他认为,药品出海到国际化的市场,主要还是为了支持药品国际化的高成本研发。比如,泽布替尼、本维英德、特普利单抗和吠喹替尼的在美国与中国的定价分别达到9倍、12倍、33倍、24倍。
同期,何如意也提示了一系列创新药出海的风险,包括美国近期出台的诸多生物医药相关政策,比如若是美国进一步加强敏感个人数据出境监管,有可能会提升药品国际临床试验样本本土化处理的成本,抬高药企出海的成本,增加创新药出海的难度。

不过,中国创新药的出海故事终不会只停留在药企间交易总额的统计上。国内创新药的实力终要靠更多的商业化数据来证明。截至目前,在商业化成绩上,百济神州的BTK抑制剂泽布替尼(商品名:百悦泽)依旧占据领先优势。
在百济神州11月初的投资者会议上,总裁兼首席运营官吴晓滨介绍,百悦泽在第三季度内实现51%的增长,季度全球收入首突10亿美元大关,稳居美国市场领导地位,现已成为全球排名第一的BTK抑制剂。同一时期,另一款出海商业化成绩较好的创新药代表——BCMA CAR-T类产品西达基奥仑赛,在第三季度实现销售额约5.24亿美元。
此前,复宏汉霖首席商务发展官、高级副总裁曹平在接受界面新闻采访时表示,目前药企间大量合作发生在了早期资产上,但这些能否在海外获批上市、能否成就百亿美元销售额都是未知,而只有当中国公司原研开发的创新药跻身全球“重磅炸弹”行列,才标志着中国创新药真正进入一个辉煌的时代。
另在今年10月下旬,康方生物海外合作伙伴Summit Therapeutics宣布,将在2025年第四季度向美国食品药品监督管理局(FDA)提交依沃西单抗联合化疗的上市申请。当然,这不意味着产品能被获批,也无法知晓后续商业化成绩。由此看,BD出海的故事可能也才刚刚开始。
